|
||||||||||||||||
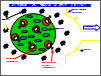
Научная деятельность Николая Альфредовича ПлатэХимия макромономеров и полимеров биомедицинского назначения Еще в 1969 г. Николай Альфредович Платэ (совместно с В.А. Каргиным) проанализировал возможности синтетических полимерных материалов в решении широкого круга медицинских проблем. Предметом изучения этой области науки, получившей название «химия медико-биологических полимеров», явились синтетические вещества и материалы, предназначенные для длительного или кратковременного контакта с тканями живого организма и обеспечивающие терапевтический результат, качественно отличный от случая использования других, традиционно применявшихся в прошлом веществ и материалов. С целью координации работ в этой области и скорейшего внедрения результатов фундаментальных исследований в практическое здравоохранение в СССР в 1968 г. при ГКНТ был создан Научный совет по синтетическим полимерам медицинского назначения, председателем которого с 1974 г. стал Н.А. Платэ. Совету удалось, главным образом благодаря личному участию Николая Альфредовича, объединить биохимиков, врачей и отраслевых инженеров и практиков, занимающихся собственно производством и использованием таких материалов, не говоря уже о содружестве ученых синтетического и физико-химического профиля в области науки о полимерах. Под председательством Н.А.Платэ было проведено десять Всесоюзных симпозиумов и две школы по полимерам медицинского назначения. Наиболее значимые результаты в области полимеров медицинского назначения были получены Н.А.Платэ с использованием разработанного им совместно с его учениками из ИНХС РАН и кафедры высокомолекулярных соединений МГУ им. М.В.Ломоносова принципиально нового подхода к химической модификации полимеров физиологически активными веществами (ФАВ). Задача создания полимера с требуемой физиологической активностью была сведена к выбору соответствующего ФАВ и иммобилизации его в объеме или на поверхности полимерного материала без существенного изменения его физиологической активности. Эта задача была успешно решена – совместно с Л.И. Валуевым и др. - с использованием впервые синтезированных ненасыщенных производных высокомолекулярных ФАВ, так называемых макромономеров. Изучение закономерностей полимеризации макромономеров и использования этой реакции для модификации полимерных веществ и материалов, а также исследования биохимических явлений, протекающих при контакте модифицированных полимеров с кровью и тканями живого организма, позволили не только предсказать поведение имплантированного в живой организм полимера и указать пути синтеза полимеров с требуемым физиологическим действием, но и создать ряд принципиально новых полимерных веществ и материалов, уже нашедших применение в практической медицине Необходимо отметить, что решение конкретных биомедицинских задач было неразрывно связано с развитием фундаментальных исследований в области науки о полимерах (проводимых совместно с Л.И. Валуевым, В.В. Чуповым и др.), позволяющих создавать надежные методы управления синтезом целевого полимера с требуемым комплексом химических, физико-механических и биохимических характеристик. Было показано, что макромономеры способны вступать в реакции гомо- и сополимеризации с низкомолекулярными мономерами с образованием водорастворимых производных, а также в реакцию тройной сополимеризации с участием бифункциональных сшивающих агентов - с получением полимерных гидрогелей, содержащих иммобилизованные ФАВ, и в реакцию привитой сополимеризации на поверхности полимерных материалов. При изучении тройной сополимеризации впервые был обнаружен эффект модификации структуры полимерных гидрогелей макромономерами, который заключался в получении высоконабухающих гидрогелей с весьма однородным распределением макропор по размерам. Крайне важно, что активность ФАВ при иммобилизации существенно не изменялась. Этому способствовала благоприятная структура полимерных гидрогелей, формирующаяся непосредственно в процессе иммобилизации ФАВ и существенно отличающаяся от структуры обычных полимерных гидрогелей. Разработанный подход позволял получать гидрогели с достаточно высокой концентрацией иммобилизованных ФАВ и в широких пределах варьировать их активность и устойчивость к денатурации. В результате оказалось возможным получать разнообразные продукты по одной технологии, что существенно для практических целей (совместно с Л.И. Валуевым, В.А. Синани, Л.Е. Ванчуговой, Л.Д. Ужиновой и др.). На основе модифицированных ингибитором протеолитических ферментов полимерных гидрогелей был создан промышленно выпускаемый в настоящее время гемосорбент «Овосорб», предназначенный для селективного удаления из крови избытка активированных протеолитических ферментов (совместно с Л.И. Валуевым, Т.А. Валуевой, В.В. Чуповым и др.). Иммобилизация в таких гидрогелях нескольких ФАВ, включая клетки микроорганизмов, позволила синтезировать ряд новых каталитических систем, в которых возникают принципиально новые надмолекулярные образования ФАВ. Так, был создан химический реактор для избирательного извлечения билирубина из сложных биологических жидкостей. Основой реактора являлся гидрогель, в котором были иммобилизованы три ФАВ - сывороточный альбумин, глюкозооксидаза и пероксидаза хрена. Альбумин сорбировал из крови билирубин, концентрируя его в непосредственной близости от молекулы пероксидазы. Глюкозоксидаза генерировала в системе перекись водорода за счет окисления содержащейся в растворе глюкозы, а пероксидаза катализировала окисление билирубина образующейся перекисью водорода. Продукт окисления - биливердин вымывался в раствор, освобождая место связывания на молекуле альбумина для новой молекулы билирубина. Используя иммобилизованные структурные аналоги ингибитора тромбина в качестве лигандов, удалось синтезировать высокоэффективные биоспецифические сорбенты для получения чистых и активных препаратов тромбина – важнейшего фермента, участвующего в процессе свертывания крови. По той же технологии были получены сорбенты для выделения и очистки препаратов карбоксильных протеиназ. Н.А.Платэ и Л.И. Валуев впервые использовали биоспецифические взаимодействия для направленного транспорта частиц полимерных гидрогелей, что позволило решить проблему создания полипептидных препаратов, устойчивых к протеолизу. Эти препараты получали физической иммобилизацией полипептида в полимерном гидрогеле, модифицированном ингибитором протеолитических ферментов и полисахаридом. Ингибитор предотвращал гидролиз полипептида протеолитическими ферментами, а полисахарид обеспечивал концентрирование препарата на стенках тонкого кишечника за счет биоспецифического взаимодействия с содержащимися на слизистой оболочке кишечника лектинами. В результате был создан препарат инсулина для перорального применения - «Рансулин». Положительные результаты широкомасштабных испытаний этого препарата, в том числе и клинические исследования, проведенные в ведущих медицинских учреждениях страны, свидетельствуют о перспективности его использования для лечения сахарного диабета (совместно с Л.И. Валуевым, Т.А. Валуевой, Г.А. Сытовым и др.). При использовании глюкозосодержащих синтетических полимеров, сшитых конканавалином А, были разработаны модели оригинальных химических реакторов, функционирующих по механизму обратной связи и способных выделять предварительно введенный в них инсулин в ответ на повышение концентрации глюкозы в окружающей среде, то есть моделирующих функцию поджелудочной железы. На примере широкого круга ФАВ был разработан и экспериментально проверен критерий сохранения физиологической активности при модификации поверхности полимера ФАВами, который заключается в создании вокруг иммобилизованного ФАВ гидрофильного окружения. При этом макромолекула ФАВ присоединяется к поверхности полимера посредством длинной полимерной цепи – «ножки», что обеспечивает достаточную подвижность этой макромолекулы и ее доступность для молекул субстрата. Изучена возможность применения привитой сополимеризации макромономеров ФАВ и их смесей, воздействующих на процессы тромбообразования и/или фибринолиза, для повышения гемосовместимости полимерных материалов. Совместно с Л.И. Валуевым сформулирована общая концепция получения гемосовместимых полимерных материалов, включающая, как обязательное условие, локальную гипокоагуляцию граничащих с полимером слоев крови. Используя такой подход, удалось синтезировать ряд модифицированных материалов, которые во многом удовлетворяют потребностям сердечно-сосудистой и восстановительной хирургии, а также других областей медицины, связанных с хранением, переливанием крови, выделением из нее отдельных компонентов и т.п. Путем химической модификации поверхности полимеров биоспецифическими сорбентами были синтезированы материалы, способные избирательно сорбировать из крови соединения, предотвращающие свертывание крови, концентрируя их на поверхности материала и повышая, тем самым, его гемосовместимость. Оригинальным является предложенный в работах Н.А.Платэ и Л.И. Валуева новый подход к направленному транспорту ФАВ, в том числе и в живом организме, который включает иммобилизацию ФАВ на полимерном носителе, имеющем нижнюю критическую температуру смешения, и нагревание мишени до температуры выше критической. Созданные в ИНХС РАН модифицированные различными лекарственными препаратами гидрогели нашли широкое применение в клинике в качестве дренажей при лечении вторичной глаукомы, а также в качестве эндопротезов глазного яблока . В 2002 г. работы Н.А.Платэ, Л.И. Валуева и Т.А. Валуевой по созданию полимеров медицинского назначения были удостоены Государственной премии Российской федерации в области науки и техники. В 70-е – 80-е гг. Николай Альфредович выступил инициатором и организатором работ по созданию полимерных лекарственных форм нового поколения для контролируемой доставки терапевтического агента в орган – мишень по заданной программе. Результаты этих исследований были обобщены в монографии Н.А. Платэ и А.Е. Васильева «Физиологически активные полимеры», Москва, Химия, 1986. В русле этой тематики в 1979 г. была начата разработка трансдермальных терапевтических систем (ТТС) для введения лекарственных веществ в систему кровообращения посредством диффузии их молекул непосредственно через эпителий кожи из адгезионной полимерной матрицы ТТС. Для этой цели впервые в мировой практике потребовалось создать новый гидрофильный полимерный адгезив, совместимый с лекарственными веществами различной химической структуры. По итогам клинических исследований, в конце 80-х – начале 90-х годов Минздрав СССР разрешил для применения в медицинской практике ТТС с нитроглицерином, изосорбида динитратом, цитизином, клонидином, феназепамом и лекарственный противогрибковый пластырь с хинозолом. В 1991 году эта разработка была отмечена золотой, серебряной и бронзовой медалями ВДНХ СССР. В 1995 г. в ИНХС РАН (совместно с. М.М. Фельдштейном, В.Г. Куличихиным и др.) были начаты широкомасштабные исследования молекулярной природы адгезии, чувствительной к давлению. Было показано, что факторами, определяющими на молекулярном уровне адгезионную способность смесей полимеров, является сочетание высокой энергии когезии с большим свободным объемом. Разработанная на этой основе в ИНХС РАН технология совместно с известной фармацевтической компанией Corium International, Inc., США внедрена в промышленность, в результате на международном фармацевтическом рынке появился ряд аппликационных лекарственных препаратов, покрытий для лечения ран и ожогов, а также ТТС. |
|
|||||||||||||||